포화 화합물 및 불포화 화합물
포화 화합물(飽和化合物, 영어: saturated compound)은 화학에서 수소화, 산화적 첨가 및 루이스 염기의 결합과 같은 첨가 반응에 저항하는 화합물(또는 이온)로 탄소 원자들 사이에 단일 결합만 존재하는 화합물이다. 불포화 화합물(不飽和化合物, 영어: unsaturated compound)은 탄소 원자들 사이에 이중 결합이나 삼중 결합을 하나 이상 가지고 있는 화합물이다. 이드 용어는 많은 상황에서 다양한 종류의 화합물에 사용된다. 전반적으로 포화 화합물은 불포화 화합물보다 반응성이 낮다. 포화라는 이름은 "채우다(to fill)"를 의미하는 라틴어 "saturare"에서 파생되었다.[1]
유기화학
[편집]불포화 화합물은 일반적으로 알케인과 같은 포화 화합물로는 불가능한 전형적인 첨가 반응을 수행한다. 포화 유기 화합물은 탄소 원자들 사이에 단일 결합만 갖는다. 포화 화합물은 중요한 부류는 알케인이다. 많은 포화 화합물에는 하이드록실기와 같은 작용기가 있다.
| 포화 화합물 | |
|---|---|

|

|
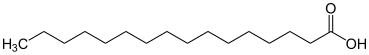
| |
불포화 유기 화합물
[편집]포화의 개념은 다양한 명명 체계, 공식, 분석 시험을 사용하여 설명할 수 있다. 예를 들어 IUPAC 명명법은 유기 화합물 내의 불포화 유형과 위치를 설명하는 데 사용되는 명명 규칙 체계이다. 불포화도는 화합물이 결합할 수 있는 수소의 양을 요약하고 도표화하는 데 사용되는 공식이다. 불포화도는 핵자기 공명(NMR), 질량분석 및 적외선 분광법으로 측정하거나 화합물의 브로민값 또는 아이오딘값을 측정하여 결정할 수 있다.[2]
| 불포화 화합물 | |
|---|---|

|
|

| |
지방산
[편집]
포화 및 불포화라는 용어는 보통 지방의 구성 요소인 지방산에 적용된다. 탤로를 구성하는 트라이글리세라이드(중성 지방)는 포화된 스테아르산과 단일불포화된 올레산에서 파생된다.[3] 많은 식물성 기름에는 1개(단일불포화) 또는 2 이상(다중불포화)의 이중 결합을 가지고 있는 지방산이 포함되어 있다.
유기화학을 벗어난 포화 화합물 및 불포화 화합물
[편집]유기금속화학
[편집]유기금속화학에서 배위적으로 불포화된 착물은 18개 미만의 원자가 전자를 가지므로 추가 리간드의 산화적 첨가 또는 배위를 받기 쉽다. 불포화는 많은 촉매들의 특징이다. 배위 불포화의 반대는 배위 포화이다. 배위적으로 포화된 착물은 촉매 특성을 거의 나타내지 않는다.[4][5]
표면
[편집]물리화학에서 표면 과정을 언급할 때 포화는 결합 부위가 완전히 차지하는 정도를 나타낸다. 예를 들어 염기 포화는 염기 양이온인 교환 가능한 양이온의 비율을 나타낸다.
같이 보기
[편집]각주
[편집]- ↑ Mosby's Medical, Nursing & Allied Health Dictionary, Fourth Edition, Mosby-Year Book Inc., 1994, p. 1394
- ↑ Smith, Michael B.; March, Jerry (2007), 《Advanced Organic Chemistry: Reactions, Mechanisms, and Structure》 6판, New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ↑ Alfred Thomas (2002). 〈Fats and Fatty Oils〉. 《Ullmann's Encyclopedia of Industrial Chemistry》. Weinheim: Wiley-VCH. doi:10.1002/14356007.a10_173. ISBN 3527306730.
- ↑ Hartwig, J. F. Organotransition Metal Chemistry, from Bonding to Catalysis; University Science Books: New York, 2010. ISBN 1-891389-53-X
- ↑ “IUPAC definition of Coordinatively Unsaturated Complex”.
